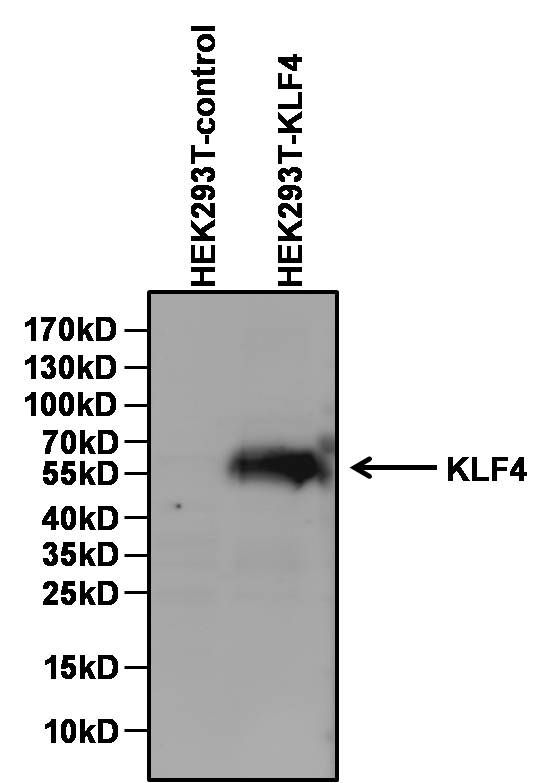
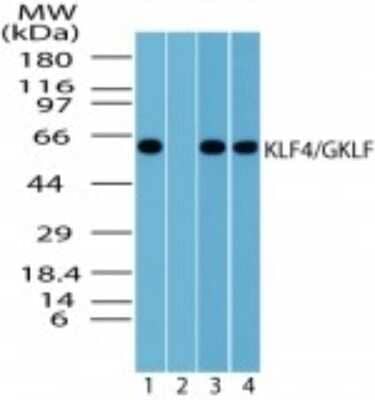
KLF4(Kruppel like factor 4)は、ジンクフィンガー型転写因子であるKLFファミリーの一員である。KLFファミリーはSp1様転写因子とともにSp1-like/KLFファミリーを構成する転写因子群である。KLF4は細胞増殖、分化、アポトーシス、体細胞のリプログラミングの調節に関与している。また、KLF4は大腸がんなど特定のがんでがん抑制因子として機能することを示唆する証拠が得られている。KLF4のC末端には3つのC2H2型ジンクフィンガーが存在し、これらはKLF2と密接な関係にある。また、2つの核局在配列が存在し、KLF4を細胞核へ局在させるシグナルとなっている。胚性幹細胞では、KLF4は幹細胞性の良い指標となることが実証されている。このことは、間葉系幹細胞にも当てはまる。
ヒトのKLF4タンパク質はKLF4遺伝子にコードされ、513アミノ酸からなり、約55 kDaと推定される。KLF4遺伝子はチンパンジー、アカゲザル、イヌ、ウシ、マウス、ラット、ニワトリ、ゼブラフィッシュの間で保存されている。KLF4は1996年に初めて同定された。
相互作用
KLF4はN末端領域を介してp300/CBPコアクチベーターファミリーと相互作用し、転写を活性化することができる。一方、KLF4による転写抑制は、アクチベーターの標的DNAへの結合に対しKLF4が競合することで行われる。
KLF4はテロメラーゼの酵素サブユニット(TERT)のプロモーター領域に存在することも示されており、そこではβ-カテニンと複合体を形成している。KLF4はTERTのプロモーター領域へのβ-カテニンの蓄積に必要であるが、β-カテニンが存在しない場合にはTERTの発現を促進することはできない。
機能
KLF4は多様な機能を持ち、その機能の一部は見かけ上矛盾したようなものであること、そして何より人工多能性幹細胞(iPS細胞)の誘導に必要不可欠な4つの因子のうちの1つとして重要な役割を果たしていることが発見されたことにより、近年大きな関心を集めている。KLF4は非分裂細胞で高度に発現しており、その過剰発現は細胞周期の停止を誘導する。KLF4はDNAが損傷した際の細胞分裂の阻害に特に重要である。また、KLF4は中心体や染色体の数の調節(遺伝的安定性)や、細胞の生存の促進にも重要である。しかしながら、KLF4は特定の条件下では細胞生存促進から細胞死促進へ、その機能を切り替えている可能性が一部の研究で明らかにされている。
KLF4は腸管上皮において細胞分裂を行っていない細胞や終末分化した細胞で発現しており、腸管上皮の恒常性(さまざまな腸管上皮細胞種の終末分化と適切な局在)の調節に重要な役割を果たしている。腸管上皮においては、KLF4は分化を調節するWntシグナル経路の遺伝子の重要な調節因子である。
KLF4は他にもさまざまな組織や器官で発現している。角膜ではKLF4は上皮バリア機能に必要であり、角膜の恒常性の維持に必要な遺伝子の調節因子である。皮膚でも透過バリア機能の構築に必要であり、骨や歯の組織では正常な骨格の発達を調節している。マウスの生殖器の上皮細胞でも発現しており、オスでは適切な精子形成に重要である。血管内皮細胞では炎症刺激に応答した血管漏出の防止に重要であり、血液細胞では炎症応答や細胞分化、増殖を媒介している。腎臓に関しては、in vitroにおける胚性幹細胞やiPS細胞の腎臓系統への分化に関与しており、KLF4の調節異常はいくつかの腎臓疾患と関連している。
疾患における役割
KLF4の疾患における役割は状況依存的であり、状況によって正反対の役割を果たす可能性があることが示されている。
KLF4は抗腫瘍形成因子であり、大腸がん、胃がん、食道扁平上皮がん、小腸がん、前立腺がん、膀胱がん、肺がんなど、ヒトのさまざまながんにおいて発現が喪失していることが多い。しかしながら、一部のがんではKLF4が腫瘍のプロモーションに関与している可能性があり、口腔扁平上皮がんや原発性乳管がんなどではKLF4の発現は増大している。また、皮膚でのKLF4の過剰発現は過形成や異形成を引き起こし、扁平上皮がんの発生につながる。同様の知見は食道上皮でも得られており、マウスではKLF4の過剰発現は炎症の増大を引き起こし、最終的には食道扁平上皮がんの発生につながる。
上皮間葉転換(EMT)におけるKLF4の役割に関しても議論がある。膵臓がん、頭頸部がん、子宮体がん、上咽頭がん、前立腺がん、非小細胞肺がんでは、KLF4はがん細胞の幹細胞性の維持や促進を刺激することが示されている。一方で、前立腺がんや膵臓がんなどKLF4がEMTを促進することが示されている系においても、TGF-β誘導性のEMT条件下ではKLF4がEMTを抑制することが示されている。さらに、皮膚がん、乳がん、肺がん、シスプラチン抵抗性上咽頭がんでは、KLF4がEMTを抑制することが示されている。
KLF4はいくつかの血管疾患で重要な役割を果たしており、マクロファージの極性化やアテローム性動脈硬化におけるプラーク形成を制御することで血管の炎症を調節することが示されている。KLF4は、抗アテローム性因子であるアポリポプロテインEをアップレギュレーションする。また、KLF4は血管新生の調節にも関与している。KLF4はNOTCH1の活性を調節することで血管新生を抑制している可能性がある一方で、中枢神経系ではKLF4の過剰発現は血管の異形成を引き起こす。
マウスのマクロファージ、食道上皮、そして薬剤起因性大腸炎などにおいては、KLF4がNF-κB依存的な炎症経路を介して炎症を促進している可能性が示されている。しかしながら、炎症促進刺激に応答した内皮細胞などではKLF4が炎症シグナルの活性化を抑制ている可能性が示されている。
KLF4はDNA損傷に対する細胞応答に必要不可欠である。KLF4はガンマ線照射によるDNA損傷後の有糸分裂への進行の阻害に必要であり、DNA修復機構を促進し、照射細胞のプログラム細胞死(アポトーシス)を防ぐ。腸管上皮特異的にKLF4を欠失したマウスではガンマ線照射後の腸管上皮の再生が行われず、致死率が増加することから、この応答におけるKLF4の重要性がin vivoで示されている。
幹細胞における重要性
高橋和利と山中伸弥によって、KLF4がマウスの胎児や成体の線維芽細胞を多能性幹細胞(iPS細胞)へ誘導するために必要な4つの因子のうちの1つ(他の3つはOct3/4、Sox2、c-Myc)であることが同定された。この4つの因子はヒトの成人の線維芽細胞に対しても当てはまることが発見されている。この2006年の発見以降現在に至るまで、幹細胞やその誘導に関する臨床的に重要な研究は劇的に増加した。一方で、幹細胞におけるin vivoでのKLF4の機能研究は比較的少数である。腸管幹細胞の一集団であるBmi1 幹細胞の分裂は通常は遅く、放射線照射に対する抵抗性を持ち、照射損傷後の腸管上皮の再生を担う集団であることが知られている。ガンマ線照射によるDNA損傷後の腸管では、KLF4はBmi1 幹細胞の運命、そしてBmi1 幹細胞由来の細胞系統の発生を調節することで腸管の再生を調節している。
出典
関連文献
関連項目
- KLFファミリー
外部リンク
- KLF4 protein, human - MeSH・アメリカ国立医学図書館・生命科学用語シソーラス(英語)
- KLF4 microarray expression results and literature